Cell:揭示一种常见遗传的人类PCSK9生殖系变体增加乳腺癌转移风险
来源:生物谷原创 2024-12-24 11:25
一项新的研究表明:携带PCSK9 V474I变体的患者在15年内面临22%的转移风险,而没有这种变体的患者只有2%的风险。
90%的癌症死亡是由于癌症的扩散,而不是原发肿瘤的并发症。因此,50多年来,科学家们一直在寻找肿瘤内哪些恶性突变允许流氓细胞脱离原发肿瘤,并通过血液和淋巴系统转移到全身。
但是,一项新的研究表明,另一种机制被忽视了——驱动转移的难以捉摸的突变可能不是在肿瘤本身扭曲的DNA中发生的,而是在患者的正常遗传DNA中发生的。这一发现首次证明了乳腺癌转移的遗传易感性,具有深远的临床意义,有可能提供一种潜在的预防方法。
相关研究结果于2024年12月9日在线发表在Cell期刊上,论文标题为“A commonly inherited human PCSK9 germline variant drives breast cancer metastasis via LRP1 receptor”。

论文通讯作者、洛克菲勒大学的Sohail Tavazoie教授说,“我们认为转移至少在一定程度上是一种遗传性疾病。我们如此专注于癌细胞,即‘种子(seeds)’,以至于忽略了生殖系(germline)——‘土壤(soil)’。如今很明显,关注土壤是至关重要的。”
问题的根源
尽管科学家们几十年来一直在严格研究转移,但是对转移性肿瘤的广泛基因组测序却一无所获。患者肿瘤充满了突变基因,但没有一个被证明能特异性地驱动转移。Tavazoie说,“因此,我们假设可能是宿主自身的遗传,而不是肿瘤,提供了这些突变。”
事实上,Tavazoie及其同事之前已证实,APOE的多种生殖系等位基因可以增强或抑制黑色素瘤的转移。为了查明乳腺癌转移是否以类似的方式进行,Tavazoie实验室对来自多个国家的大量患者群体进行了人类遗传学研究。
PCSK9基因的一种常见变体(V474I)立即引起了他们的注意。在70%的白人女性生殖系中,这种变体与乳腺癌症生存率降低有关。当Tavazoie及其团队对小鼠进行基因改造使之携带人类PCSK9的相关变体形式时,它们的乳腺癌转移率增加了。
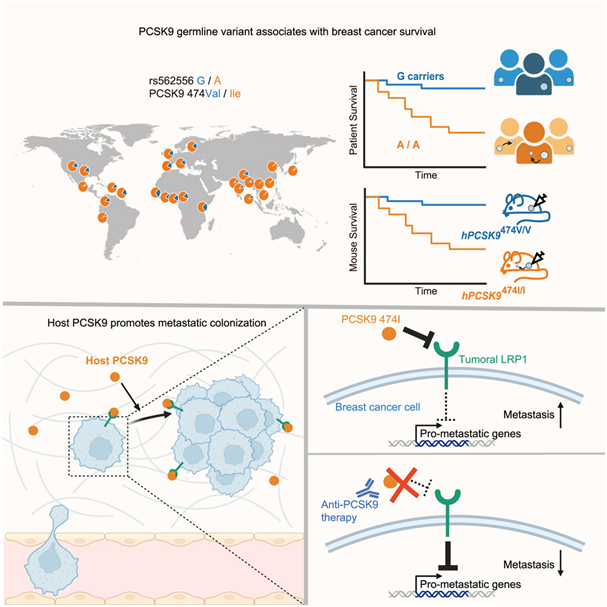
瑞典隆德大学的同事们通过对斯堪的纳维亚早期乳腺癌患者的大量队列分析进一步验证了这些结果。他们的发现很明显:携带PCSK9 V474I变体的患者在15年内面临22%的转移风险,而没有这种变体的患者只有2%的风险。
论文第一作者、Tavazoie实验室的研究生Wenbin Mei说,“我们的研究结果强调了涉及来自多个国家的研究人员和患者群体的国际合作的重要性。此外,这表明人类遗传学已经变得多么强大。有了将计算分析与实验模型相结合的新技术,我们正处于一个回答难题的伟大时代。”
深入挖掘
这项新的研究还揭示了PCSK9 V474I变体如何驱动转移。通过降解癌细胞表面上的LRP1受体,这种变体似乎引发了一系列适合于转移起始的基因激活。有趣的是,Tavazoie实验室之前对黑色素瘤的研究已发现,促进或抑制转移的APOE等位基因也作用于LRP1。Tavazoie说,“值得注意的是,在两种不同的癌症中,转移机制都集中在这一受体上。”该实验室未来的研究工作将集中于LRP1在转移中发挥的潜在一致的作用。
尽管如今有证据表明这种PCSK9变体与转移性疾病有关,但Tavazoie澄清说,携带这种变体的患者不应感到恐慌。他们的数据表明,携带这种变体的患者有22%的转移风险,而没有这种变体的风险为2%。他说,“大多数携带任何一种PCSK9变体的早期乳腺癌患者仍然不会发生转移。”
但是,他如今对减少22%不幸人群的转移性疾病的可能性持乐观态度。这项研究还表明PCSK9可以用一种阻断PCSK9活性的抗体来抑制,该抗体已经批准用于治疗高胆固醇。
Tavazoie说,“这是一种安全且耐受性良好的药物。”他同时提醒说,临床试验对于证明它在癌症中的疗效是必要的。“我们希望有一天,携带这种变体的高危患者能够得到积极治疗,通过靶向引发这一结果的特定信号来减少转移的机会。”(生物谷 Bioon.com)
参考资料:
Wenbin Mei et al. A commonly inherited human PCSK9 germline variant drives breast cancer metastasis via LRP1 receptor. Cell, 2024, doi:10.1016/j.cell.2024.11.009.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


